Tryptophane synthase
La tryptophane synthase, ou tryptophane synthétase, est une lyase qui catalyse les réactions :
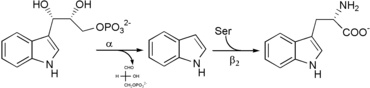
- 1-C-(indol-3-yl)glycérol-3-phosphate indole + D-glycéraldéhyde-3-phosphate ;
- L-sérine + indole L-tryptophane + H2O.
Cette enzyme catalyse les deux dernières étapes de la biosynthèse du tryptophane, l'un des 20 acides aminés standard entrant dans la composition des protéines. Elle est présente chez les bactéries, les archées et certains eucaryotes, en particulier les plantes et les champignons. Elle est absente chez les mammifères, pour lesquels le tryptophane est un acide aminé essentiel.
La tryptophane synthase est une enzyme bi-fonctionnelle, comportant deux sites actifs, portés par deux types de sous-unités différentes. La sous-unité α catalyse la formation d'indole à partir d'indole-3-glycérol phosphate. La sous-unité β catalyse la condensation de l'indole sur la sérine pour former le tryptophane.