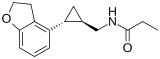
Tasimeltéon
Tasimelteon, vendu sous le nom Hetlioz, est un médicament approuvé par la Food and Drug Administration (FDA)[1] des États-Unis en janvier 2014, pour le traitement du syndrome hypernycthéméral. En juin 2014, l'Agence européenne des médicaments (EMA) a accepté une demande d'autorisation dans l'UE pour le tasimeltéon[2] et en juillet 2015, le médicament a été approuvé pour le traitement du syndrome hypernycthéméral chez les adultes aveugles[3], mais pas dans le cas plus rare du syndrome hypernycthéméral chez les personnes voyantes.
| Tasimeltéon | |
| |
| Informations générales | |
|---|---|
| Princeps | Hetlioz, Hetlioz LQ |
| Données pharmacocinétiques | |
| Excrétion |
80% in urine, 4% in feces |
| Identification | |
| No CAS | |
| No ECHA | 100.114.889 |
| Code ATC | N05CH03 |
| DrugBank | 09071 |
Les effets secondaires les plus courants sont les maux de tête, la somnolence, les nausées (sensation de malaise) et les étourdissements[4].
Notes et références
- « FDA transcript approval minutes », FDA,
- « tasimelteon (Hetlioz) UKMi New Drugs Online Database » (consulté le )
- « Hetlioz Receives European Commission Approval for the Treatment of Non-24-Hour Sleep-Wake Disorder in the Totally Blind », MarketWatch, (consulté le )
- « Hetlioz EPAR », European Medicines Agency (EMA) (consulté le )
Liens externes
- « Tasimelteon », Drug Information Portal, U.S. National Library of Medicine
- Portail de la médecine
Cet article est issu de Wikipedia. Le texte est sous licence Creative Commons – Attribution – Partage à l’identique. Des conditions supplémentaires peuvent s’appliquer aux fichiers multimédias.