Tétrahydruroborate de sodium
Le tétrahydruroborate de sodium, aussi appelé borohydrure de sodium, est un composé chimique constitué d'atomes de bore, de sodium et d'hydrogène. Sa formule brute est NaBH4.
| Tétrahydruroborate de sodium | |||
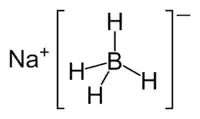
| |||
| Formule développée du tétrahydruroborate de sodium | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | Tétrahydruroborate de sodium | ||
| Synonymes |
Borohydrure de sodium |
||
| No CAS | |||
| No ECHA | 100.037.262 | ||
| No CE | 241-004-4 | ||
| Apparence | solide blanc | ||
| Propriétés chimiques | |||
| Formule | NaBH4 | ||
| Masse molaire[1] | 37,833 ± 0,007 g/mol H 10,66 %, B 28,58 %, Na 60,77 %, |
||
| Propriétés physiques | |||
| T° fusion | ~400 °C[2] | ||
| T° ébullition | ~500 °C (décomp.) [2] | ||
| Solubilité | 55 g/100 ml (eau, 25 °C), 16,4 g/100 ml (méthanol, 20 °C), |
||
| Masse volumique | 1,074 g·cm-3 | ||
| Précautions | |||
| SIMDUT[4] | |||
  B6, D2B, |
|||
| Transport | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
C'est un agent réducteur utilisé notamment dans l'industrie pharmaceutique en tant que source d'hydrures H−. C'est un solide blanc, souvent rencontré sous forme de poudre.
Synthèse
Le borohydrure de sodium est synthétisé industriellement selon la méthode Schlesinger[5]: l'hydrure de sodium est traité avec du borate de triméthyle à 250-270 °C:
- B(OCH3)3 + 4 NaH → NaBH4 + 3 NaOCH3
Le borohydrure de sodium est l'hydrure réducteur le plus synthétisé[6]. Le borohydrure de sodium peut également être synthétisé en faisant réagir de l'hydrure de sodium, NaH sur du verre borosilicaté en poudre[7].
Réactivité
Le borohydrure de sodium absorbe l'humidité de l'air (il est hygroscopique). Il réagit de façon relativement modérée avec l'eau et dégage lentement du dihydrogène, un gaz inflammable/explosif. Selon la classification européenne des produits chimiques, il est néanmoins enregistré avec la phrase de risque R14 "réagit violemment au contact de l'eau". Le produit se décompose à plus de 400 °C sans fondre. Le borohydrure de sodium permet de réduire un aldéhyde ou une cétone en alcool.
Pile à combustible
Le borohydrure de sodium est aussi utilisé dans les systèmes expérimentaux de pile à combustible comme un moyen de stocker l'hydrogène. C'est écologique car il se dégrade en sel inerte quand il est relâché dans l'environnement[réf. nécessaire].
Voir aussi
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (fr) Données de sécurité (Carl Roth)
- (en) Steven F. Pedersen et Arlyn M. Myers, Understanding the Principles of Organic Chemistry : A Laboratory Course, Cengage Learning, , 406 p. (ISBN 978-0-495-82993-5 et 0-495-82993-5, lire en ligne), p. 274
- « Borohydrure de sodium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Methods of preparing alkali metal borohydrides, (lire en ligne)
- Peter Rittmeyer et Ulrich Wietelmann, « Hydrides », dans Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH Verlag GmbH & Co. KGaA, (ISBN 3527306730, lire en ligne)
- H. C. Brown, A. Khuri et S. C. Kim, « ChemInform Abstract: Addition compounds of alkali métal hydrides. 13. Reaction of alkali metal hydrides with trialkylboranes. Synthessis and dissociation of alkali metal trialkylborohydrides. Ethyk ethet-organoborane as a reversible 'solvent' for lithium », Chemischer Informationsdienst, vol. 8, no 50, , no–no (ISSN 0009-2975, DOI 10.1002/chin.197750312, lire en ligne, consulté le )
- Portail de la chimie
