Tétracyanoéthylène
Le tétracyanoéthylène, généralement abrégé en TCNE, également appelé éthylène tétracarbonitrile, est un composé chimique de formule (N≡C)2C=C(C≡N)2. Il se présente sous forme d'un solide jaune semiconducteur de type n (accepteur d'électrons) qui peut donner des sels de Bechgaard. Il s'hydrolyse en libérant du cyanure d'hydrogène HCN en présence d'humidité et doit donc être manipulé avec les précautions qui s'imposent.
| Tétracyanoéthylène | |
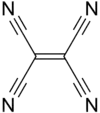 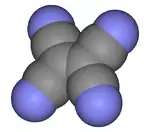 Structure du TCNE |
|
| Identification | |
|---|---|
| Nom UICPA | éthène-1,1,2,2-tétracarbonitrile |
| Synonymes |
éthylène tétracarbonitrile |
| No CAS | |
| No ECHA | 100.010.527 |
| No CE | 211-578-0 |
| PubChem | 12635 |
| SMILES | |
| InChI | |
| Apparence | solide jaune |
| Propriétés chimiques | |
| Formule | C6N4 |
| Masse molaire[1] | 128,091 ± 0,005 6 g/mol C 56,26 %, N 43,74 %, |
| Propriétés physiques | |
| T° fusion | 198,85 °C [2] |
| T° ébullition | 223,05 °C [2] |
| Thermochimie | |
| ΔfH0gaz | 688,1 kJ·mol-1 [2] |
| ΔfH0solide | 607,1 kJ·mol-1 [2] |
| Unités du SI et CNTP, sauf indication contraire. | |
Les groupes –C≡N ont des orbitales π* de basse énergie, de sorte que quatre groupes cyano conjugués avec la double liaison centrale constituent un système accepteur d'électrons. Le traitement du TCNE avec des iodures donne ainsi l'anion correspondant :
- C2(CN)4 + I − → [C2(CN)4] − + ½ I2
Compte tenu de son caractère d'accepteur d'électrons et de sa configuration plane, le TCNE a été utilisé pour préparer de nombreuses structures supraconductrices organiques en formant des complexes à transfert de charge.
Articles liés
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Tetracyanoethylene », sur NIST/WebBook, consulté le 17 juin 2009
- Portail de la chimie
- Portail de l’électricité et de l’électronique