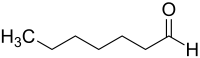
Heptanal
L'heptanal ou n-heptanal est un aldéhyde de formule semi-développée CH3(CH2)5CHO.
| Heptanal | |
| |
| Identification | |
|---|---|
| Nom UICPA | heptan-1-al |
| Synonymes |
n-heptanal, énanthal |
| No CAS | |
| No ECHA | 100.003.545 |
| No CE | 203-898-4 |
| PubChem | 8130 |
| FEMA | 2540 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore à l'odeur désagréable[1] |
| Propriétés chimiques | |
| Formule | C7H14O [Isomères] |
| Masse molaire[2] | 114,185 5 ± 0,006 9 g/mol C 73,63 %, H 12,36 %, O 14,01 %, |
| Propriétés physiques | |
| T° fusion | −43,4 °C [3] |
| T° ébullition | 152,8 °C [3] |
| Solubilité | 1,25 g·l-1 (eau, 25 °C)[1] |
| Masse volumique | 0,813 2 g·cm-3 (liquide, 25 °C) [3] |
| T° d'auto-inflammation | 205 °C[1] |
| Point d’éclair | 39,5 °C (coupelle fermée)[1] |
| Limites d’explosivité dans l’air | 1,1 — 5,2 vol.%[1] |
| Pression de vapeur saturante | 5,0 hPa (20 °C) 6,6 hPa (25 °C)[1] |
| Viscosité dynamique | 0,791 mPa·s[1] |
| Propriétés optiques | |
| Indice de réfraction | 1,411 3 [3] |
| Précautions | |
| SGH[1] | |
  Attention |
|
| Transport | |
| Écotoxicologie | |
| DL50 | 3 200 mg·kg-1 (rat, oral)[4] > 5 000 mg·kg-1 (lapin, dermique)[4] |
| LogP | 2,8[1] |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés
L'heptanal se présente sous la forme d'un liquide incolore, inflammable, légèrement volatil, avec une odeur pénétrante, fruité à huileuse-graisseuse[5]. Il est miscible avec les alcools[6] mais pratiquement insoluble dans l'eau[1]. Du fait de sa forte sensibilité à l'oxydation, l'heptanal est généralement conditionné sous azote et stabilsé avec 100 ppm d'hydroquinone[7].
Son point d'éclair est de 39,5 °C et son point d'auto-inflammation de 205 °C[1]. Il forme des mélanges explosifs avec l'air dans les limites d'explosivité de 1,1 et 5,2 vol.%[1].
Occurrence naturelle et synthèse
L'heptanal est naturellement présent dans les huiles essentielles d'ylang-ylang (Cananga odorata), de sauge sclarée (Salvia sclarea), de citron (Citrus x limon), d'orange amère (Citrus x aurantium), de rose (Rosa) et de jacinthe (Hyacinthus)[6]. La formation d'heptanal lors de la distillation fractionnée de l'huile de ricin a été décrite dès 1878[8].
La production a large échelle de l'heptanal repose sur le clivage pyrolytique de l'acide ricinoléique[9] (procédé Arkema) et sur l'hydroformylation de l'hex-1-ène en présence d'acide 2-éthylhexanoïque et d'un catalyseur de 2-éthylhexanoate de rhodium (procédé Oxea)[10],[11] :
![]()
Utilisations
L'heptan-1-ol peut être produit par réduction/hydrogénation de l'heptanal :

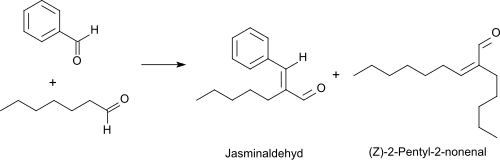
L'oxydation de l'heptanal par le dioxygène en présence de catalyseurs au rhodium à 50 °C permet d'obtenir de l'acide heptanoïque avec un rendement de 95 %[12]. L'heptanal peut réagir par condensation de Knoevenagel avec le benzaldéhyde sous catalyse basique pour donner le jasminaldéhyde, avec un rendement et une sélectivité élevée (> 90%)[13],[10], un composé avec une odeur caractéristique de jasmin dont un mélange d'isomère cis/trans est utilisé en parfumerie [14].
Notes et références
- Entrée « Heptanal » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 07/03/2023 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) William M. Haynes, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 91e éd., 2610 p. (ISBN 9781439820773, présentation en ligne), p. 3-274
- National Technical Information Service. Vol. OTS0533620,
- « Richtwerte für gesättigte azyklische aliphatische C4- bis C11-Aldehyde in der Innenraumluft », Bundesgesundheitsblatt - Gesundheitsforschung - Gesundheitsschutz, vol. 52, no 6, , p. 650–659 (DOI 10.1007/s00103-009-0860-2, lire en ligne)
- G. A. Burdock, Fenaroli’s Handbook of Flavor Ingredients, Fifth Edition, Boca Raton, Fl., CRC Press, (ISBN 0-8493-3034-3).
- Acros Organics, Heptaldehyde, stabilized, consulté le 19 novembre 2012.
- F. Krafft, Distillation of castor oil, under educed pressure, Analyst, 3, 329a (1878).
- A. Chauvel, G. Lefebvre, Petrochemical Processes: Technical and Economic Characteristics, Band 2, S. 277, Editions Technip, Paris, 1989, (ISBN 2-7108-0563-4).
- Christian Kohlpaintner, Markus Schulte, Jürgen Falbe, Peter Lappe, Jürgen Weber, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, (DOI 10.1002/14356007.a01_321.pub2), « Aldehydes, Aliphatic »
- Deutsche Patentschrift DE 102007053385, Verfahren zur Herstellung von Aldehyden, Erfinder: A. Fischbach et al., Anmelder: Oxea Deutschland GmbH, veröffentlicht am 20. Mai 2009.
- Deutsche Patentschrift DE 10010771, Verfahren zur Herstellung aliphatischer Carbonsäuren aus Aldehyden, Erfinder: H. Springer, P. Lappe, Anmelder: Celanese Chem Europe GmbH, veröffentlicht am 3. Mai 2001.
- María Pérez-Sánchez et Pablo Domínguez de María, « Synthesis of natural fragrance jasminaldehyde using silica-immobilized piperazine as organocatalyst », Catalysis Science & Technology, vol. 3, no 10, , p. 2732 (DOI 10.1039/C3CY00313B)
- Riechstofflexikon A, alpha-Amylzimtaldehyd, Letzte Änderung am 4. August 2000.
- Portail de la chimie
