Bicarbonate d'ammonium
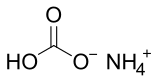
Le bicarbonate d'ammonium (formule NH4HCO3) est un sel bicarbonate de l'ammonium.
| Bicarbonate d'ammonium | |
| |
| Identification | |
|---|---|
| Nom UICPA | Hydrogénocarbonate d'ammonium |
| No CAS | |
| No ECHA | 100.012.647 |
| No CE | 213-911-5 |
| No E | E503(ii) |
| Apparence | cristaux incolores ou blancs, d'odeur caractéristique[1]. |
| Propriétés chimiques | |
| Formule | NH4HCO3 |
| Masse molaire[2] | 79,055 3 ± 0,002 3 g/mol C 15,19 %, H 6,37 %, N 17,72 %, O 60,71 %, |
| Propriétés physiques | |
| T° fusion | (décomposition) : 35 à 60 °C[1] |
| T° ébullition | 106 °C sublime[réf. souhaitée] |
| Solubilité | dans l'eau à 20 °C : 174 g L−1[1] |
| Masse volumique | 1,58 g cm−3[1] |
| Pression de vapeur saturante | 79 Pa (25,4 °C)[réf. souhaitée] |
| Précautions | |
| SIMDUT[3] | |
Produit non contrôlé |
|
| Unités du SI et CNTP, sauf indication contraire. | |
C'est un produit irritant pour la peau, les yeux et le système respiratoire.
Il est utilisé dans l'industrie agroalimentaire comme poudre à lever en association ou non avec d'autres sels comme le bicarbonate de soude.
Propriétés
- Apparence : à température ambiante, c'est une poudre blanche.
- Solubilité dans l'eau : le bicarbonate d'ammonium est très soluble dans l'eau, qu'il rend alcaline (basique, à pH élevé). Sa dissolution est endothermique, c'est-à-dire qu'elle absorbe de la chaleur et que la température de la solution baisse en absence d'apport externe de chaleur.
- Il porte le numéro E503(ii) comme additif alimentaire.
Voir aussi
- Bicarbonate de sodium (bicarbonate de soude)
- Carbonate d'ammonium
Références
- HYDROGENOCARBONATE D'AMMONIUM, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Bicarbonate d'ammonium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009.
- Portail de la chimie
Cet article est issu de Wikipedia. Le texte est sous licence Creative Commons – Attribution – Partage à l’identique. Des conditions supplémentaires peuvent s’appliquer aux fichiers multimédias.