Acide periodique
L'acide periodique est la molécule HIO4 (acide métaperiodique) ou H5IO6 (acide orthoperiodique). Le nom de la molécule ne provient pas du mot « période », mais de « iode » : acide per-iodique (à comparer avec acide iodique ou acide perchlorique).
| Acide periodique | |
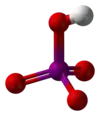 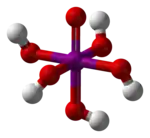 Structure des acides méta- et orthoperiodique. |
|
| Identification | |
|---|---|
| Nom UICPA | acide periodique periodate d'hydrogène |
| No CAS | |
| No ECHA | 100.030.839 |
| No CE | 233-937-0 |
| PubChem | 25289 |
| Propriétés chimiques | |
| Formule | H5IO6 [Isomères] |
| Masse molaire[1] | 227,940 6 ± 0,002 2 g/mol H 2,21 %, I 55,67 %, O 42,11 %, |
| Propriétés physiques | |
| T° fusion | 122 °C[réf. souhaitée] |
| Précautions | |
| SIMDUT[2] | |
 C, |
|
| Directive 67/548/EEC | |
 C  O |
|
| Unités du SI et CNTP, sauf indication contraire. | |
En solution diluée, l'acide periodique existe sous la forme d'ions H+ et IO4−. En concentration plus élevée, l'acide orthoperiodique, H5IO6, est formé. Celui-ci peut être obtenu sous forme cristalline.
Par chauffage sous pression réduite à 100 °C, l'acide orthoperiodique peut être déshydraté en acide métaperiodique, HIO4 :
- H5IO6 HIO4 + 2 H2O.
L'anhydride (heptoxyde de diiode, I2O7) ne peut être obtenu. En poursuivant le chauffage jusqu'à 150 °C environ, on obtient le pentoxyde de diiode (I2O5) :
- 2HIO4 → H2O + I2O5 + O2.
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Acide periodique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Portail de la chimie
Cet article est issu de Wikipedia. Le texte est sous licence Creative Commons – Attribution – Partage à l’identique. Des conditions supplémentaires peuvent s’appliquer aux fichiers multimédias.