Acide hypofluoreux
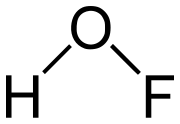
L'acide hypofluoreux est un acide faible très instable de formule chimique HOF. C'est le seul oxoacide connu du fluor. Ses sels, inconnus pour l'instant sont les hypofluorites.
| Acide hypofluoreux | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | Acide hypofluoreux | |
| No CAS | ||
| PubChem | 123334 | |
| Apparence | Solide blanc (<−117 °C), liquide jaune pâle (>−117 °C)[1] | |
| Propriétés chimiques | ||
| Formule | HFO [Isomères] |
|
| Masse molaire[2] | 36,005 7 ± 0,000 4 g/mol H 2,8 %, F 52,76 %, O 44,44 %, |
|
| Propriétés physiques | ||
| T° fusion | −117 °C[1] | |
| T° ébullition | 10 à 20 °C[1] | |
| Propriétés électroniques | ||
| 1re énergie d'ionisation | 12,71 ± 0,01 eV (gaz)[3] | |
| Composés apparentés | ||
| Autres composés | ||
| Unités du SI et CNTP, sauf indication contraire. | ||
C'est le seul acide hypohalique qui a pu être isolé à l'état solide.
C'est un intermédiaire dans l'oxydation de l'eau par le difluor qui produit du fluorure d'hydrogène et du dioxygène.
F2 + H2O → HOF + HF
Il se décompose d'ailleurs de façon explosive en fluorure d'hydrogène et dioxygène.
2HOF → 2HF + O2
Notes et références
- Nils Wiberg, Egon Wiberg, Arnold Fr. Holleman Lehrbuch der Anorganischen Chemie,de Gruyter, (ISBN 978-3-11-017770-1), Édition=102, 2007.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205.
- Portail de la chimie
Cet article est issu de Wikipedia. Le texte est sous licence Creative Commons – Attribution – Partage à l’identique. Des conditions supplémentaires peuvent s’appliquer aux fichiers multimédias.