1-Fluoro-2,4-dinitrobenzène
Le 1-fluoro-2,4-dinitrobenzène, ou réactif de Sanger, couramment appelé dinitrofluorobenzène (DNFB), est un composé chimique de formule C6H3F(NO2)2. Il est utilisé dans le séquençage de peptides tels qu'hormones peptidiques, protéines et enzymes.
| 1-Fluoro-2,4-dinitrobenzène (réactif de Sanger) | |
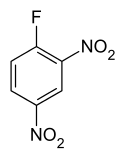 Structure du 1-fluoro-2,4-dinitrobenzène |
|
| Identification | |
|---|---|
| Nom UICPA | 1-Fluoro-2,4-dinitrobenzène |
| Synonymes |
Réactif de Sanger, |
| No CAS | |
| No ECHA | 100.000.668 |
| No CE | 200-734-3 |
| PubChem | 6264 |
| ChEBI | 53049 |
| SMILES | |
| InChI | |
| Apparence | solide jaune cristallisé |
| Propriétés chimiques | |
| Formule | C6H3FN2O4 [Isomères] |
| Masse molaire[1] | 186,097 4 ± 0,006 6 g/mol C 38,72 %, H 1,62 %, F 10,21 %, N 15,05 %, O 34,39 %, |
| Propriétés physiques | |
| T° fusion | 25 à 27 °C[2] |
| T° ébullition | 178 °C[2] |
| Masse volumique | 1,482 g·cm-3[2] à 25 °C |
| Point d’éclair | 164 °C[2] |
| Précautions | |
| SGH[2] | |
  Attention |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Sa synthèse a été décrite en 1904 par Holleman et Beekman à partir de 4-fluoronitrobenzène, lui-même obtenu précédemment à partir de 4-nitroaniline[3], puis sa production à partir de 1-chloro-2,4-dinitrobenzène par réaction avec le fluorure de potassium KF dans le nitrobenzène C6H5NO2 a été mise au point en 1936 par Gottlieb[4] :
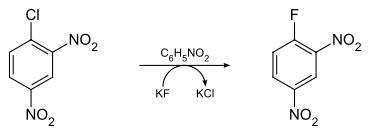
Cette méthode de synthèse a par la suite été optimisée afin d'en améliorer le rendement[5].
Le biochimiste britannique Frederick Sanger, qui reçut le prix Nobel de chimie en 1958 puis en 1980, a décrit en 1945 l'application de ce composé au séquençage de l'insuline, plus précisément à la détermination de l'acide aminé de l'extrémité N-terminale de ses chaînes polypeptidiques[6].
Dans cette méthode, l'acide aminé N-terminal d'une chaîne peptidique réagit avec le DNFB et se retrouve « marqué » par un résidu dinitrophényle ; il ne reste plus qu'à identifier l'acide aminé lié au dinitrophényle une fois tous les acides aminés libérés par hydrolyse acide complète du polypeptide pour connaître l'acide aminé N-terminal d'une chaîne peptidique.
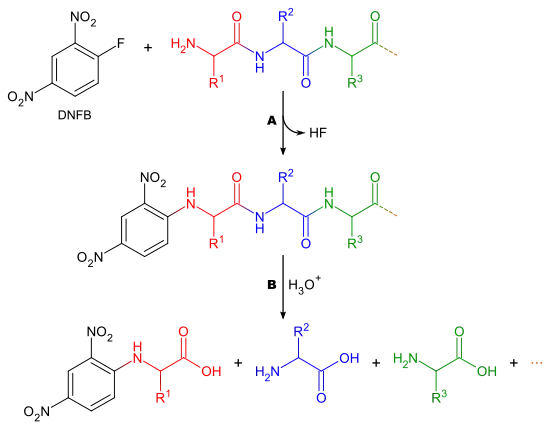
A : fixation d'un résidu dinitrophényle sur l'acide aminé N-terminal
B : hydrolyse acide totale du polypeptide, libérant tous les acides aminés, dont l'acide aminé N-terminal lié au résidu dinitrophényle.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé 1-fluoro-2,4-dinitrobenzène ≥ 99 %, consultée le 5 avril 2013.
- A. F. Holleman et J. W. Beekman, « Recherches sur les corps aromatiques fluorés », Recueil des Travaux Chimiques des Pays-Bas et de la Belgique, vol. 23, no 7, , p. 240 (lire en ligne)
- (en) Hans Billroth Gottlieb, « The Replacement of Chlorine by Fluorine in Organic Compounds », Journal of the American Chemical Society, vol. 58, no 3, , p. 532–533 (lire en ligne) DOI 10.1021/ja01294a502
- (en) H.G. Cook et B.C. Saunders, « 1:2:4-Fluorodinitrobenzene », Biochemical Journal, vol. 41, no 4, , p. 558 (lire en ligne)
- (en) Frederick Sanger, « The free amino groups of insulin », Biochemical Journal, vol. 39, no 5, , p. 507-515 (lire en ligne)
- Portail de la chimie